A microscopia MINFLUX permite a determinação de distâncias dentro de biomoléculas usando um microscópio óptico
Uma equipe liderada pelos físicos Steffen Sahl e Stefan Hell do Instituto Max Planck de Ciências Multidisciplinares em Göttingen e do Instituto Max Planck de Pesquisa Médica em Heidelberg conseguiu medir distâncias dentro de biomoléculas usando um microscópio óptico, até um nanômetro e com precisão de Éngström . A resolução intramolecular alcançada com a microscopia MINFLUX torna possível registrar opticamente as distâncias espaciais entre subunidades em macromoléculas e, assim, detectar diferentes conformações de proteínas individuais no microscópio óptico.
Qual é a aparência do nanocosmo das células vivas? A microscopia de fluorescência permite visualizar moléculas específicas em células ou tecidos e tornou-se parte integrante da pesquisa biológica e médica básica. Com a ajuda de novos conceitos de nanoscopia de fluorescência de alta resolução, como a microscopia MINFLUX, até mesmo biomoléculas pouco espaçadas podem ser separadas umas das outras usando um microscópio óptico. Obter imagens precisas do interior das células é uma coisa, mas a microscopia de fluorescência também pode ser usada para medir detalhes dentro de proteínas individuais ou outras macromoléculas?
Como demonstraram agora os investigadores liderados por Sahl e Hell, é possível. E funciona muito bem. Em seu último trabalho, a equipe mostrou que o método MINFLUX também pode ser usado para medir opticamente a distância tridimensional entre dois marcadores moleculares fluorescentes, cada um ligado a um local específico de uma macromolécula – e isso com a precisão de Éngström.
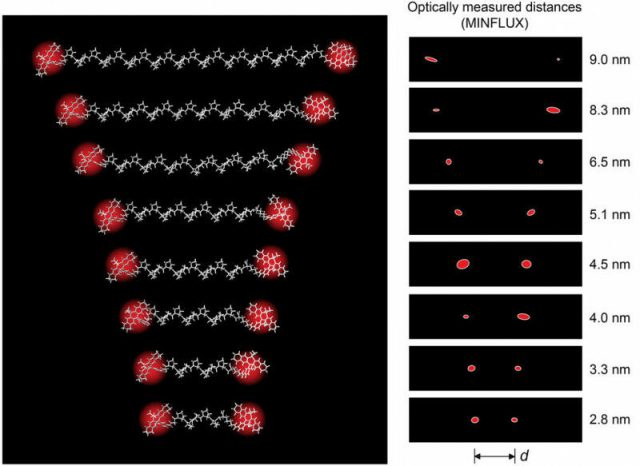
Medir distâncias de alguns nanômetros entre duas moléculas fluorescentes espacialmente ancoradas era concebível com o MINFLUX, mas não é tão fácil de implementar ou demonstrar experimentalmente. -Em distâncias inferiores a 5 a 10 nanômetros, as moléculas fluorescentes, que têm cerca de 1 nanômetro de tamanho, frequentemente interagem umas com as outras. Como resultado, eles não podem emitir a sua luz fluorescente independentemente um do outro – o pré-requisito para uma medição de distância confiável, – explica Sahl, principal autor do estudo. -Como muitos outros, fiquei fascinado pela alta resolução espacial e precisão que é possível com o método MINFLUX proposto e desenvolvido por Stefan Hell,- diz o físico. -No início do nosso trabalho havia uma estimativa: é assim que as proteínas são pequenas e é assim que podemos ser precisos em princípio. Por que não realizamos resoluções dentro de uma biomolécula?” Porque até agora, detectar distâncias nanométricas entre duas proteínas, ou suas subunidades, tem sido prerrogativa de um método denominado transferência de energia de ressonância de Förster, ou FRET, para abreviar, um método padrão em biologia estrutural e molecular.
Avançando na faixa FRET
Sahl, Hell e seus colegas também avançaram nesta faixa de resolução com a microscopia MINFLUX. Eles usaram moléculas fluorescentes fotoativadas especialmente desenvolvidas no Instituto Max Planck de Ciências Multidisciplinares, que podem ser ligadas uma após a outra com uma pequena dose de luz ultravioleta, mas não interagem entre si. Desta forma, as posições a serem medidas na macromolécula poderiam ser marcadas com uma única molécula fluorescente e registradas de forma independente com precisão de Éngström.
-Mostramos que com o MINFLUX todas as distâncias – até o contato direto das moléculas fluorescentes – podem ser medidas. Para isso, basta determinar as posições das moléculas em duas ou três dimensões, ou seja, 2D ou 3D,- explica Sahl. -Com nossos experimentos, alcançamos a faixa de distância do FRET e até vamos além dela.-
FRET, por outro lado, estima a distância entre duas moléculas de corante indiretamente através da transferência de energia de um corante para o outro. Não apenas a distância, mas também as orientações das moléculas do corante afetam o resultado da medição. Isto pode levar a incertezas quando se trata de medir com precisão a distância intramolecular. O método FRET também tem sido frequentemente limitado em estudos de subunidades proteicas quando elas se movem fora da faixa de distância mensurável. -É aqui que o método MINFLUX pode demonstrar seus pontos fortes, representando corretamente todas as distâncias concebíveis até 1 nanômetro, sem quaisquer lacunas,- diz Hell. -MINFLUX é, portanto, uma ferramenta nova e muito poderosa no repertório da biologia estrutural para investigar proteínas e outras biomoléculas e suas interações.-
De réguas moleculares e pequenas moléculas de proteínas

Para demonstrar a medição precisa e a precisão da distância, a equipe de pesquisa usou uma molécula com a qual o método FRET realmente começou em um experimento clássico na década de 1960. Naquela época, Lubert Stryer e Richard Haugland conseguiram confirmar a dependência da distância publicada por Theodor Förster em 1948. Para fazer isso, eles usaram réguas moleculares de comprimento médio definido chamadas poliprolinas. Os pesquisadores do Max Planck usaram agora exatamente essas réguas em seus experimentos – e mostraram que o método pode, em princípio, ser usado até em células.
Em colaboração com o grupo de pesquisa de Stefan Jakobs no Instituto Max Planck de Ciências Multidisciplinares, proteínas laminas marcadas com fluorescência em células humanas, que formam filamentos finos de aproximadamente 3 nanômetros na membrana ao redor do núcleo celular, foram fotografadas separadamente usando o método MINFLUX. Além disso, os cientistas demonstraram o potencial do MINFLUX através de experimentos com outras pequenas proteínas, denominadas nanocorpos, e seus oligômeros. Usando moléculas de anticorpos como exemplo, eles mostraram como múltiplas medições de posição tornam possível resolver a posição espacial das subunidades proteicas umas em relação às outras.
Usando duas subunidades idênticas do sensor de citrato bacteriano, a equipe, em colaboração com o Departamento de Christian Griesinger do Instituto Max Planck de Ciências Multidisciplinares, demonstrou que até distâncias de 1 nanômetro podem ser medidas. A microscopia MINFLUX também revelou claramente os dois arranjos estruturais das subunidades com uma precisão na faixa de 1 Éngström.
Hell, que recebeu o Prêmio Nobel de Química em 2014 pelo desenvolvimento da microscopia de super-resolução, está satisfeito: -Desde que demonstramos pela primeira vez o conceito MINFLUX em 2016, ele mais uma vez ultrapassou radicalmente os limites da microscopia óptica. Ser capaz de resolver dentro de macromoléculas não era realmente previsível em 2014.-
Sahl, SJ; Matias, J.; Inamdar, K.; Weber, M.; Khan, TA; Bruser, C.; Jacobs, S.; Becker, S.; Griesinger, C.; Broichhagen, J.; Inferno, SW